Lupus eritematoso sistémico revisión de la fisiopatología. El lupus eritematoso sistémico tiene una etiología poco clara. Una predisposición genética (marcador genético HLA, o leucocitos antígenos humanos), la presencia de anti DNA anticuerpos, y factores ambientales, como una infección viral parecen estar ligados a el desarrollo de esta patología. Esta condición es más prevalente en mujeres en edades jóvenes y es más común en afroamericanas que en caucásicas. En 1954 la tasa de supervivencia era de 50%, ahora es de 97%. Cerca del 25% de las personas que presentan Lupus eritematoso sistémico también pueden desarrollar el síndrome de Sjögren.
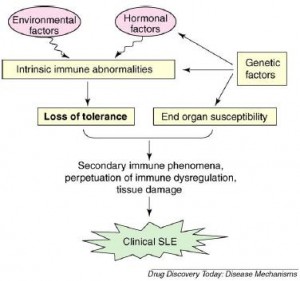
La tolerancia inmunológica se encuentra perdida por numerosos antígenos propios del sistema inmunológico que atacan múltiples tejidos. Esta es una enfermedad que se manifiesta por una inflamación crónica que puede afectar a cualquier órgano o tejido, comúnmente la piel, las articulaciones, la sangre y los riñones. Los principales iniciadores de la patología son diversos anticuerpos como se mencionó antes, complejos inmunes, factores del complemento y células autoreactivas. La alteración biológica por las células inmunológicas, los queratinocitos, células endoteliales y muy probablemente otro tipo de células de manera independiente contribuyen a la aparición de esta enfermedad. (Observe diagrama # 1).
El desarrollo del Lupus en los infantes se pudo establecer en una corte de 76 personas de una muestra de 1000 personas con lupus en un estudio llamado «Euro-Lupus», quienes desarrollaron esta patología después de los 14 años de edad. Con un radio de mujer/hombre de 7/1que no varía mucho de la población adulta en predisposición al género 10/1. Además los patrones clínicos de los niños con lupus difieren totalmente de los pacientes adultos. El desarrollo de esta patología en menores muy frecuentemente involucra severamente órganos con manifestaciones como la nefropatía. Otras complicaciones mayores como los compromisos neurológicos, trombocitopenia, y anemia hemolítica son una constante en este grupo de edad.
PATOGÉNESIS DEL LUPUS ERITEMATOSO SISTÉMICO
Diagrama #1: perdida de la tolerancia a los múltiples antígenos propios es el centro de la patogénesis del Lupus Eritematoso Sistémico. Los factores genéticos por la susceptibilidad del sistema inmunológico, sumados a la influencia ambiental y los factores hormonales estocásticos son incapaces de mantener la tolerancia a lo propio. Esto aclara un poco más el entendimiento el daño a determinados tejidos (ej.: nefritis) adicional a lo anterior, la susceptibilidad de las terminaciones de algunos órganos por tener tendencia a la agregación de los complejos inmunes se encuentran genéticamente mediados.
El diagnóstico inicial en los niños siempre se hace de manera retardada, esto debido a que los médicos tardan mucho en reconocer la semiología de la patología. Por ejemplo en la corte del estudio mencionado con antelación el promedio de identificación de la patología fue de aproximadamente 5 años en establecer esta.
La historia natural de la enfermedad está caracterizada por episodios de recaídas o complicaciones severas, de remisiones constantes e intercambios de conceptos médicos. Donde tiene la mayor tasa de mortalidad por las remisiones constantes y el tratamiento no especifico. En el transcurso de los años, el tratamiento ha disminuido la morbilidad y la mortalidad de esta patología, que incluye el uso conservativo de corticoesteroides e inmunosupresores. Sumado a esto las nuevas tendencias del manejo de la patología y los hallazgos descubiertos sobre la patología.
Avances en Lupus Eritematoso Sistémico: polimorfismo en la tirosina kinasa 2 y el factor interferon regulatorio 5, genes asociados con la patología. El lupus es una enfermedad compleja del sistema inmune causada principalmente por factores genéticos y ambientales.
El aumento en la producción del interferon 1 y la expresión de algunos genes que producen este comportamiento son muy comúnmente observados en el lupus haciendo de esta una patología netamente una enfermedad molecular. Sigurdsson S. et al. (Am J Hum Genet 2005; 76:528-37), analizaron 44 nucleótidos sencillos en el polimorfismo de 13 genes en la vía del interferon 1 en 679 suecos. En dos de los genes, de la tirosina kinasa 2 y el factor interferon regulatorio 5 los autores encontraron este polimorfismo que mostró fuertes señales en la asociación con la enfermedad. Estos resultados revelan que el lupus tiene componentes claves que involucran principalmente al interferon 1.
NEFRITIS LUPICA EN NIÑOS
En el Lupus Eritematoso Sistémico el compromiso renal es más frecuente en niños que en adultos. Cerca de un 60 a 80% de los niños con lupus cursan con anormalidades urinarias y de función renal. En el 90% de los pacientes la enfermedad renal se manifiesta dos años después del establecimiento de la enfermedad. La significancia clínica del compromiso renal de estos pacientes varía con hallazgos asintomáticos urinarios, hasta síndrome nefrótico y falla renal. El pronóstico a tiempo largo es el mismo que en los adultos. El tratamiento es poco peculiar en los infantes, pero trae consigo efectos colaterales, como el retraso en el crecimiento por el uso de los esteroides, entre otros. La gran mayoría de niños con nefritis lúpica presentan proteinuria y/o hematuria microscópica persistente. La hipertensión ha sido reportada como en un 40% de los pacientes y la mitad de estos tienen complicaciones renales crónicas. En el desarrollo de la enfermedad se presenta una proteinuria severa, hematuria y bajos niveles de albumina sérica que lleva al uso de drogas antihipertensivas que agudizan las crisis renales.
La lesión renal se manifiesta en clínica en 40 a 85% de los enfermos con lupus y varía desde anomalías aisladas del sedimento urinario hasta síndrome nefrítico o nefrótico floridos o insuficiencia renal crónica. La mayor parte de las lesiones glomerulares comienzan por la formación de inmunocomplejos dentro de la pared del capilar glomerular; sin embargo, la causa fundamental de la disfunción renal en un pequeño subgrupo de enfermos con el síndrome de anticuerpos antifosfolipídicos es microangiopatía trombótica. La biopsia renal ha resultado muy útil para detectar los diferentes patrones de glomerulonefritis por inmunocomplejos en el lupus, que son diversos, se asocian a pronósticos distintos y no siempre se corresponden con los datos clínicos. De hecho, la nefritis lúpica clínicamente asintomática es muy bien conocida; el análisis de orina es casi siempre normal, pero la biopsia renal muestra daños en grado variable.
INSUFICIENCIA RENAL CRÓNICA
La definición de esta patología varía en muchas partes del mundo. La pérdida gradual y progresiva de la capacidad de los riñones para excretar desechos, concentrar la orina y conservar los electrolitos. Básicamente se trata de una tasa de filtración glomerular por debajo de 75ml/min/l.73m2, y esta se pueda subdividir en varios grupos o niveles: tasa de filtración glomerular media 50-75ml/min/l.73m2, moderada 30-50ml/min/l.73m2, y severa 10-30ml/min/l.73m2, con un estadio final de falla renal defiendo este como una tasa de filtración glomerular menor a 10ml/min/l.73m2.
La fisiopatología de la CRD implica mecanismos iniciadores específicos de la causa, así como una serie de mecanismos progresivos que son una consecuencia común del decremento de la masa renal, cualquiera que sea la etiología. Dicha reducción de la masa renal causa hipertrofia estructural y funcional de las nefronas supervivientes. Esta hipertrofia compensadora es mediada por moléculas vasoactivas, citocinas y factores de crecimiento, y se debe inicialmente a hiperfiltración adaptativa, a su vez mediada por aumento de la presión y el flujo capilares glomerulares. Con el tiempo, estas adaptaciones a corto plazo se revelan desfavorables, ya que predisponen a la esclerosis de la población residual de nefronas viables. El aumento de la actividad intrarrenal del eje renina-angiotensina parece contribuir tanto a la hiperfiltración adaptativa inicial como a las posteriores hipertrofia y esclerosis perjudiciales.
La definición de CRD requiere que el proceso fisiopatológico antes descrito dure más de tres meses. Una clasificación internacional reciente muy aceptada divide la CRD en varias etapas que se definen por estimación clínica de la filtración glomerular (glomerular filtration rate, GFR). Estas etapas ayudan a orientar los criterios clínicos diagnóstico y terapéutico. Primero, es de gran importancia identificar los factores que incrementan el riesgo de CRD, incluso en los individuos con una GFR normal. Estos factores consisten en antecedentes familiares de enfermedad renal hereditaria, hipertensión, diabetes, enfermedad autoinmunitaria, edad avanzada, crisis previa de insuficiencia renal aguda y pruebas actuales de lesión renal con GFR normal o incluso incrementada. Tales manifestaciones de lesión renal en presencia de GFR normal o aumentada colocan a los pacientes en la etapa 1 de la CRD y consisten en proteinuria, sedimento urinario anormal o anomalías estructurales de las vías urinarias (p. ej., reflujo vesicoureteral) que se aprecian en los estudios de imágenes. Incluso en esta etapa, en que la GFR basal es normal, se encuentra a menudo una pérdida característica de la reserva renal. Esta etapa incipiente está bien comprobada de manera particular en la nefropatía diabética.
La albuminuria sirve como instrumento adjunto de importancia clave para vigilar la lesión de la nefrona y la reacción al tratamiento en muchas formas de CRD. Las guías de referencia publicadas en la actualidad recomiendan el empleo de tiras reactivas sumergibles para medir específicamente la albuminuria o cuantificarla a través de la razón entre albúmina y creatinina en una muestra de la primera orina de la mañana.
La etiología de la Insuficiencia Renal Crónica en los niños es definitivamente diferente a como se presenta en los adultos, con una causa antenatal determinada en un 50% de los casos. Esto referido a que los nefrólogos pediatras son usualmente muy demorados en tener remisiones, con cerca de 35% de pacientes con Insuficiencia en estadio terminal y 25% con una severa falla renal crónica.
La mayoría de las ocasiones tiene un componente congénito que causa un daño renal irreversible o puede ser adquirido perinatalmente como un daño en el cual los riñones no vuelven a recuperar su función normal.
La agenesis renal bilateral y una displasia renal multiquística son incompatibles para sobrevivir por el oligohidramnios severo causado por la ausencia en la producción de orina fetal que acarrea una hipoplasia pulmonar letal. La displasia renal es usualmente asociada con un espeso reflujo bilateral vesículo urético o con una uropatía obstructiva, siendo estas las causas más comunes de una verdadera Insuficiencia Renal Crónica congénita. Es dos veces mayor en niño que en niñas por que los hombres predominan las válvulas uretales posteriores y el reflujo bilateral vesículo urético. Las causas adquiridas incluyen: trombosis bilateral arterial o venosa y una necrosis tubular aguda que progresa hasta una necrosis renal cortical.
La Insuficiencia Renal Crónica puede presentarse como resultado de una amplia variedad de diferentes enfermedades renales. Comúnmente el 90% de los pacientes que desarrollan Insuficiencia Renal Crónica es consecuencia de patologías agregadas como la Diabetes mellitus, glomerulonefritis e hipertensión. Cuando estas patologías se vuelven crónicas y comprometen la función renal, el riñón se vuelve incapaz de excretar los productos de desecho, de mantener el balance hidroelectrolítico y producir hormonas. Cuando la Insuficiencia Renal crónica progresa el nivel circulante en el plasma de los productos de desecho eventualmente aparecen los síntomas de Uremia.
La uremia es definida clínicamente como un síndrome que causa malestar general, debilidad, nauseas, vomito, calambres musculares, picazón, sabor metálico en la boca y frecuentemente desórdenes neurológicos que cursan con niveles de residuos nitrogenados elevados en el cuerpo. Estas manifestaciones no son muy específicas y varían de paciente en paciente. Los parámetros bioquímicos de laboratorio tienen como regla general clasificar este patología cuando: el nitrógeno ureico en plasma (BUN) está por encima de 100mg/dl y la creatinina de 10 a 12 mg/dl estos como aproximación directa al problema patológico.
BIBLIOGRAFÍA
- A MEGUID EL NAHAS, AMINU K BELLO. Chronic kidney disease: the global challenge. Lancet 2005; 365: 331-40.
- ZARAZAGA, L. GARCÍA DE LORENZO, P. P. GARCÍA LUNA, P. GARCÍA-PERIS, J. LÓPEZ MARTÍNEZ, V. LORENZO, L. QUECEDO, J. DEL LLANO. Nutritional support in chronic renal failure: systematic review. Clinical Nutrition (2001) 20(4): 291-299.
- Christina G. Katsiari, George C. Tsokos. Systemic lupus erythematosus: From disease pathogenesis to therapy. Toren Finkel – National Heart, Lung and Blood Institute, National Institutes of Health, USA Charles Lowenstein – The John Hopkins School of Medicine, Baltimore, USA. Published by Elsevier Ltd. DOI: 10.1016/j.ddmec.2006.05.007.
- Dennis L. Kasper, Eugene Braunwald, Anthony S. Fauci, Stephen L. Hauser, Dan L. Longo, J. Larry Jameson, and Kurt J. Isselbacher, Eds. HARRISON. Principles of internal medicine. Mc GrawHill. 2005.
- F Perfumo1 and A Martini. Lupus nephritis in children. www.lupus-journal.com. 2005 Edward Arnold (Publishers) Ltd.
- George B. Haycock. Management of acute and chronic renal failure in the newborn. Seminars in Neonatology (2003) 8, 325-334.
- Ian J.Ramage and Anne M.Durkan. Principles of management in chronic renal failure. Current Pediatrics (2003) 13, 496-501. Elsevier Ltd. All rights reserved.
- Ricard Cervera. Systemic lupus erythematosus in Europe at the change of the millennium: Lessons from the bEuro-Lupus ProjectQ. Autoimmunity Reviews 5 (2006) 180- 186.
- Silvia Spinazz, Dirk Schrijvers. Metabolic emergencies. Critical Reviews in Oncology/Hematology 58 (2006) 79-89.
- Son-Mi Chung. Chang-Keun Lee. En Young Lee .Bien Yoo. Sang-Do Lee. Hee-Bom Moon. Clinical aspects of pulmonary hypertension in patients with systemic lupus erythematosus and in patients with idiopathic pulmonary arterial hypertension. Clinical Rheumatology 2006.