Transplante hepático por cirrosis alcohólica
PALABRAS CLAVES
Trasplante hepático, Child C, Meld 12, cirrosis alcohólica, estado nutricional, soporte nutricional.
PREAMBULO DEL TRASPLANTE HEPÁTICO
El trasplante hepático se ha convertido en una opción real para los pacientes.
Los centros de trasplante hepático en el país realizan, en promedio, 50 trasplantes por año. Pero ante la escasez de donantes se requiere optimizar y determinar qué pacientes y en qué momento deben ser considerados para trasplante hepático. (1).
QUIÉNES SE TRASPLANTAN
1. Enfermedades crónicas avanzadas del hígado (cirrosis con sus complicaciones).
2. Enfermedades agudas severas del hígado (falla hepática fulminante).
3. Otras como tumores (casos especiales), enfermedades metabólicas, congénitas, trauma hepático.
ELECCIÓN DEL MOMENTO ÓPTIMO PARA ENLISTAMIENTO
Una vez se ha establecido el diagnóstico y se ha considerado que el trasplante hepático podría ser una de las opciones terapéuticas, se debe determinar cuál es el momento óptimo de remisión a un centro especializado. (2).
Indicadores generales: Son aspectos clínicos o de laboratorio que determinan, en sentido general, cuando un paciente se encuentra en una condición clínica tal que el balance riesgo-beneficio entre permanecer con o sin trasplante juega claramente a favor de este último.
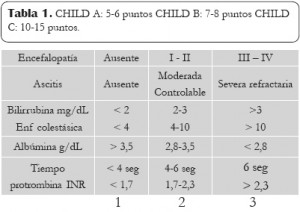
Score de Child-Pugh: Permite evaluar los pacientes de bajo y alto riesgo, pero no precisa exactamente el pronóstico, además no considera factores importantes como son la etiología y la condición renal. Esta escala de clasificación se utiliza en los centros hospitalarios como el Hospital San Ignacio de Bogotá D.C. para elegir los pacientes quienes tiene prioridad por un órgano en donación. (Ver tabla 1)
Tabla 1: Child pugh Score. Nivel de selección de prioridad
Score MELD (Model for end stage Liver Disease)
Debido a la gran cantidad de candidatos a trasplante y la conocida desproporción con la disponibilidad de órganos que determinaban una alta tasa de mortalidad en lista de espera, se vio la necesidad de contar con un modelo de predicción de riesgo de mortalidad que garantizara de la mejor manera posible la utilización de cada órgano para el paciente «más enfermo» en la lista. De esta manera aparece un modelo matemático inicialmente validado para pacientes sometidos a shunt porto sistémico transyugular (TIPS) que se basa en la utilización de tres parámetros principales: bilirrubina, INR y creatinina sérica.
MELD = 0,378 x log (bilirrubina mg/dL) + 1,12 x log (INR) + 0,957 x log (creatinina sérica mg/dL)
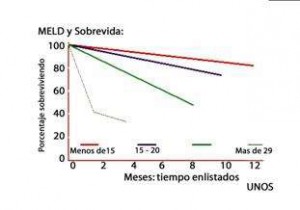
Este modelo matemático ha demostrado validez en predecir la supervivencia de pacientes según el score obtenido (Ver gráfico # 1) donde se aprecia claramente que a mayor score hay una evidente disminución de la supervivencia. (3).
Figura # 1: Score MELD
ENFERMEDAD HEPÁTICA ALCOHÓLICA
El centro de la discusión se basa en considerar el riesgo de recidiva del alcoholismo como enfermedad; para tal fin se han considerado tres niveles de riesgo así:
Bajo riesgo (16% de recaída)
Abstinencia > 6 meses
Sin recaídas previas
Buen soporte social
Sin enfermedad siquiátrica
Riesgo intermedio (80% de recaída)
Abstinencia entre 1 y 6 meses
Una o más recaídas previas
«Disposición» de ingreso a programa de rehabilitación
Soporte social deficiente
Riesgo alto (100% de recaída)
Abstinencia no documentada o < 1 mes
Múltiples recaídas
Rechaza programas de rehabilitación
Pobre o ausente soporte social
CIRRROSIS ALCOHOLICA (4)
DEFINICIÓN
La cirrosis alcohólica es sólo una de las muchas consecuencias que acarrea el consumo crónico de alcohol, y frecuentemente se asocia con otras formas de lesión hepática inducida por éste, como el hígado graso alcohólico y la hepatitis alcohólica. La cirrosis alcohólica, conocida históricamente como cirrosis de Laennec.
Se caracteriza por una cicatrización difusa y sutil, por la pérdida bastante homogénea de células hepáticas y por la aparición de nódulos de regeneración de pequeño tamaño, por lo cual se denomina a veces cirrosis micronodular.
Sin embargo, la cirrosis micronodular también puede deberse a otros tipos de lesión hepática (p. ej., tras una derivación yeyunoileal); por ello, cirrosis alcohólica y cirrosis micronodular no son necesariamente sinónimos. A la inversa, la cirrosis alcohólica puede evolucionar a una cirrosis macronodular con el paso del tiempo.
ETIOLOGÍA
La cantidad y la duración de la ingesta de alcohol son los factores de riesgo más importantes implicados en el desarrollo de la hepatopatía alcohólica. La participación de tipo de bebida y patrón de consumo es menos clara. El avance hacia la lesión hepática más allá del estadio de hígado graso parece precisar de factores de riesgo adicionales que todavía no están claramente definidos. Las mujeres están más predispuestas a la lesión hepática alcohólica que los varones; desarrollan enfermedad hepática avanzada con un consumo de alcohol sustancialmente menor que los varones. En general, el tiempo que tarda en desarrollarse la enfermedad hepática está directamente relacionado con la cantidad de alcohol consumido. Es útil estimar el consumo de alcohol para entender que una cerveza, 113.6 ml de vino o 28.4 ml de licor con 80% de alcohol contienen todos aproximadamente 12 g de alcohol. El umbral para desarrollar una enfermedad hepática alcohólica grave en los varones es un consumo superior a los 60 a 80 g/día de alcohol durante 10 años, mientras que las mujeres tienen un mayor riesgo de experimentar niveles similares de lesión hepática consumiendo tan sólo de 20 a 40 g/día.
Las diferencias entre los géneros en el metabolismo gástrico y hepático del alcohol, junto con factores hormonales mal conocidos, probablemente contribuyan a esta mayor predisposición de las mujeres a la lesión hepática inducida por el alcohol. Se han propuesto factores sociales, nutricionales, inmunológicos y del hospedador para explicar en parte el desarrollo de este proceso patógeno.
FISIOPATOLOGÍA
Si se mantiene la ingestión de alcohol y la destrucción de hepatocitos, aparecen fibroblastos (incluidas las células estrelladas, que se han transformado en miofibroblastos con propiedades contráctiles) en el lugar de la lesión y depositan colágeno. En las zonas periportales y pericentrales aparecen tabiques reticulares de tejido conjuntivo que terminan por conectar las tríadas portales y las venas centrolobulillares. Esta fina red de tejido conjuntivo rodea pequeños grupos de hepatocitos supervivientes, que se regeneran y forman nódulos. Aunque ocurre regeneración en las pequeñas zonas donde el parénquima subsiste, la pérdida celular supera su sustitución.
La destrucción persistente de hepatocitos y la acumulación de colágeno determinan que el hígado se reduzca de tamaño, adquiera un aspecto nodular y se endurezca conforme se va desarrollando la «etapa final» de la cirrosis. Aunque la cirrosis alcohólica suele ser una enfermedad progresiva, el tratamiento adecuado y la abstinencia alcohólica absoluta pueden detener la enfermedad en la mayoría de sus fases y permitir una mejoría funcional.
Además, existen datos concluyentes de que la infección concomitante por el virus de la hepatitis C (hepatitis C virus, HCV) acelera significativamente el desarrollo de la cirrosis alcohólica.
SIGNOS Y SÍNTOMAS
La cirrosis alcohólica puede ser clínicamente silenciosa y en muchos casos (10 a 40%) se descubre por casualidad en una laparotomía o en la necropsia. A menudo los síntomas tienen comienzo gradual, suelen aparecer al cabo de 10 o más años de consumo excesivo de alcohol y son lentamente progresivos a lo largo de las siguientes semanas o meses. La anorexia y la malnutrición originan pérdida de peso y decremento de la masa muscular. El paciente puede observar que aparecen equimosis con facilidad y notar debilidad creciente y astenia. En un momento dado se presentan las manifestaciones clínicas propias de la disfunción celular y de la hipertensión portal: ictericia progresiva, hemorragia por varices gastroesofágicas, ascitis y encefalopatía. La presentación brusca de una de estas complicaciones puede ser la primera manifestación que lleve al paciente a solicitar asistencia médica. En otros casos, la cirrosis se pone de relieve al acudir el paciente en búsqueda de tratamiento de síntomas relacionados con una hepatitis alcohólica.
Un signo precoz de la enfermedad suele ser la palpación de un hígado duro y nodular; el tamaño del hígado puede ser normal o estar disminuido o aumentado.
Otros signos frecuentes son ictericia, eritema palmar, angiomas en araña, aumento de tamaño de las glándulas parótidas y lagrimales, acropaquias, esplenomegalia, pérdida de masa muscular y ascitis con o sin edema periférico.
Los varones pueden presentar disminución del vello corporal, o ginecomastia y atrofia testicular, debidas, lo mismo que las alteraciones cutáneas, a trastornos del metabolismo hormonal, entre los cuales hay que señalar el aumento de la formación periférica de estrógenos debido a una reducción del aclaramiento hepático de su precursor androstendiona. La atrofia testicular puede ser consecuencia de las alteraciones hormonales o del efecto tóxico del alcohol sobre los testículos. En las mujeres se detectan ocasionalmente signos de virilización o irregularidades menstruales. La contractura de Dupuytren, debida a fibrosis de la fascia palmar y que origina contractura en flexión de los dedos, es una consecuencia del alcoholismo, pero no es específica de la cirrosis.
Aunque el paciente cirrótico puede estabilizarse si deja de beber, con el transcurso de los años aparece emaciado, débil y con ictericia crónica. La ascitis y otros signos de hipertensión portal van cobrando protagonismo. Por último, la mayoría de los pacientes con cirrosis avanzada mueren en coma hepático, que muchas veces va precedido de una hemorragia por rotura de varices esofágicas o de una infección. El trastorno progresivo de la función renal complica a menudo la fase terminal de la enfermedad.
ASPECTOS NUTRICIONALES DEL TRASPLANTE HEPATICO
Los trasplantes de hígado han cambiado dramáticamente el pronóstico, la morbilidad y la mortalidad de adultos y niños quienes padecen de enfermedades hepáticas en su estadio final. Aun así la mayoría de adultos y niños candidatos para ser trasplantados llegan al servicio clínico con malnutrición que desencadenan severas complicaciones metabólicas características del estadio final de la enfermedad. La presencia de desnutrición proteico calórica está ampliamente asociada con un mal pronóstico posoperatorio incluyendo la mala respuesta del organismo frente al injerto. (5)
El hígado es el órgano más importante metabólicamente en el cuerpo humano. Este integra una amplia variedad de complejos procesos bioquímicos de transformación de carbohidratos, proteínas y grasas, activación y almacenamiento de vitaminas y la desintoxicación y excreción de productos de desecho tanto endógenos como exógenos. En el proceso de injuria severa de este órgano conlleva a unos importantes cambios metabólicos que culminan a su vez con la desnutrición proteica calórica. (Ver tabla 2).
Es importante mencionar que los pacientes quienes son trasplantados y presentan una elevación de la tasa metabólica basal tienen bajas expectativas de supervivencia.
Recientemente se ha comprobado que la medición de la depleción de la masa celular es un mejor patrón predictivo que el tradicional Childpugh score anteriormente expuesto.
La malnutrición en pacientes con enfermedad hepática en estadio final está asociada con anormalidades en el metabolismo energético, hay una marcada reducción en la oxidación de la glucosa y un incremento en la oxidación de lípidos.
Esto es confirmado por el bajo cociente respiratorio de estos pacientes que indica el uso preferencial de la grasa como combustible.
ANORMALIDADES EN EL METABOLISMO DE LA GLUCOSA
La resistencia a la insulina está acompañada con hiperinsulinemia e hiperglucagonemia que desarrollan este tipo de pacientes y con la subsiguiente intolerancia a la glucosa. Las reservas de glucógeno hepático depletadas permiten la utilización y la movilización de la grasa como principal substrato energético durante los periodos de ayuno prolongado. (5)
ANORMALIDADES EN EL METABOLISMO DE LAS PROTEÍNAS
Se puede presentar un incremento del catabolismo proteico en las manifestaciones tempranas de la cirrosis. (5) La deficiencia proteica se empeora a medida que aumenta el daño hepático. Las alteraciones en el metabolismo de algunos aminoácidos comienzan a ocurrir. La oxidación de leucina se incrementa. La tirosina y la cisteína comienzan a ser esenciales en las enfermedades hepáticas crónicas. Se vuelve incontrolable la proteólisis ya que no puede detenerse ni con la alimentación. La pérdida de masa celular y muscular es universal en estos pacientes en lista de espera de donante, lo que refleja muy probablemente malnutrición aun con mayor certeza que la misma falla hepática.
Cambios en la tasa metabólica
- Algunos pueden conservar la tasa metabólica normal
- Cerca de un tercio presentan hipermetabolismo
Anormalidades en el metabolismo de la glucosa
- Disminución de las reservas de glucógeno
- Hiperinsulinemia
- Disminución en la oxidación de glucosa
- Intolerancia a la glucosa
- Diabetes Mellitus franca
Anormalidades en el metabolismo de las proteínas
- Incremento en el catabolismo proteico
- Acelerada gluconeogénesis con precursores aminoacidicos
Anormalidades en el metabolismo de los lípidos
- Incremento en la oxidación lipídica
- Deficiencias de ácidos grasos esenciales
Anormalidades en el metabolismo de los lípidos
En los pacientes en estadios terminales de la enfermedad hepática se presenta una deficiencia plasmática de ácidos grasos esenciales (ácido linoleico y α-linoleico) además se presenta una disminución notoria de los ácidos grasos poliinsaturados de cadena larga así mismo la concentración de ácidos grasos saturados y monoinsaturados. Esto hace que el paciente disminuya su grasa corporal y la masa libre de grasa. (5)
ESTATUS Y VALORACION NUTRICIONAL ANTES DEL TRASPLANTE HEPÁTICO
El cuidado nutricional y el conocimiento del mismo de los candidatos a trasplante hepático tienen mucha importancia ya que esto influirá en la morbilidad y mortalidad.
Desafortunadamente la valoración nutricional de estos pacientes no es una tarea muy sencilla. No existe un gold standard que determine la magnitud de la malnutrición de estos pacientes. Sin embargo nunca se debe establecer un solo criterio para realizar una valoración nutricional antes del trasplante. Esta debe ser lo más completa posible y debe incluir por lo menos: historia médica y dietaría, valoración global subjetiva, medidas antropométricas, parámetro e índices bioquímicos, y de ser posible un análisis completo de la composición corporal. (5)
TERAPIA NUTRICIONAL EN EL PRETRASPLANTE
La razón principal por la cual se le debe proveer un soporte nutricional al paciente en estadio final de la enfermedad hepática se basa en el principio de que el estatus nutricional puede influenciar el metabolismo del hígado, la función muscular y la condición inmunológica.
REQUERIMIENTOS
La meta de la terapia nutricional previa al trasplante es la de prevenir la posible depleción, cuando la repleción del estado nutricional no es posible y si el hígado ya ha perdido completamente su función de síntesis. La terapia nutricional puede prevenir la futura injuria del hígado y promover su regeneración, disminuir el deterioro funcional, minimizar el riesgo de infección y abolir las deficiencias de vitaminas y minerales.
Los requerimientos energéticos se pueden obtener por las diferentes fórmulas como la de Harris-Benedict y la calorimetría indirecta si es posible. En general el total de las calorías que se deben proveer deben estar en el orden de 1.2 veces las del metabolismo basal lo que representa aproximadamente 35kcal/kg/día.
Aproximadamente el 60 a 70% de las calorías deben provenir de carbohidratos complejos y simples, y tener mucho cuidado si hay intolerancia a la glucosa, donde se debe restringir su consumo. La grasa debe brindar el 30 a 40% de la energía restante con una fracción de preferencia de triglicéridos de cadena media si el paciente cursa con esteatorrea por mal absorción. La restricción de la proteína no debe considerarse como rutina. La encefalopatía portosistémica debe ser tratada agresivamente con terapias estándar antes de restringir por completo la proteína. Los adultos deben recibir diariamente de 1.0 a 1.2 gramos de proteína por kilogramo de peso corporal seco dependiendo del estado compensado o descompensado del hígado. En presencia de encefalopatía hepática la cantidad diaria de proteína se debe limitar a 1 gramo por kilogramo de peso corporal seco y usar preferentemente aminoácidos de cadena ramificada BCAA en formulas enriquecidas con estos.
En general, la restricción de sodio solo es necesaria en pacientes con retención de fluidos (edema y ascitis) la cantidad de agua libre no debe restringirse solo cuando el sodio sérico este por debajo de 120mmol/L.
Pacientes en estadios finales de la enfermedad hepática que estén en lista de espera de donante deben recibir diariamente multivitaminicos y suplementos apropiados para su condición como ácido fólico, zinc, magnesio, vitaminas liposolubles específicas, estos deben iniciarse mucho antes del signo de deficiencia propio del nutriente.(5)
SOPORTE ENTERAL (6)
La vía menos invasiva para la nutrición es obviamente la ruta oral, por este motivo esta debe ser la primera elección del grupo de soporte. Si esta vía falla el soporte nutricional debe ser enteral administrado por sondas de muy bajo calibre con tubos nasográstricos o nasoyeyunal. El uso de gastrostomías o yeyunostomias en paciente cirrótico con ascitis no es recomendado debido a las posibles complicaciones (peritonitis o extravasación del líquido de la ascitis).
La eficacia de las formulas enterales especializadas para pacientes hepáticos es muy alta y se ha investigado ampliamente en muchas poblaciones. Los mejores resultados se han observado en pacientes con malnutrición proteico-calórica que se han sometido a intervenciones nutricionales agresivas con este tipo de fórmulas. En general la suplementación enteral no ha empeorado la encefalopatía, la azoemia ni la ascitis. El consumo de 60 gramos de proteína en adultos, aun en pacientes con encefalopatía temprana (grado I) es soportada y se justifica en la literatura médica de hoy.
No hay duda hoy día en la evidencia de que los BCAA (aminoácidos de cadena ramificada) leucina, isoleucina y valina, suplementados por vía enteral mejoran la síntesis de proteína hepática y reducen la injuria en pacientes en estadios terminales de la enfermedad hepática. Como es conocido, los triglicéridos de cadena media se saltan la vía de la carnitina y están listos para ser utilizados por los tejidos, estos deben ser ofrecidos dentro del soporte enteral (0.3g/kg/día) son de mejor elección que los de cadena larga que son la forma predominante de grasa.
TERAPIA NUTRICIONAL POST TRASPLANTE
El objetivo principal e inmediato del paciente con trasplante hepático postquirúrgico (2 meses) es proveer una adecuada nutrición para promover la recuperación y acondicionar las reservas nutricionales depletadas en el proceso de cirugía.
Algunos centros de trasplante utilizan soporte nutricional postquirúrgico cuando se realizan operaciones o procedimientos mayores en abdomen, pero soporte para trasplante hepático aún está muy limitado. Hay mucha información que sugiere que el soporte nutricional tanto enteral como parenteral tiene muchos beneficios, donde se incluyen el balance de nitrógeno, disminución de la instancia en UCI (Unidad de Cuidados Intensivos), disminución de costos intrahospitalarios y menor infección después del trasplante.(5)
REQUERIMIENTOS
La malnutrición preoperatoria, el stress quirúrgico, la terapia de inmunosupresión y otros factores asociados que contribuyen a la persistencia del estado catabólico en el periodo postoperatorio. Inmediatamente después de la cirugía el catabolismo proteico se aumenta marcadamente y esto debe ser atacado asegurando consumos de proteína de 1.3 a 2.0g por kilogramo de peso seco. Las pérdidas de nitrógeno tienden a estabilizarse cerca del cuarto día del postoperatorio, con cifras de más o menos 15g de nitrógeno por día (90-100g de proteína/día) durante varios días. Los aminoácidos de cadena ramificada y los aromáticos deben permanecer en proporción de radio equivalente para asegurar el éxito del trasplante y evitar que se rechace el injerto.
La mezcla de combustible debe contener carbohidratos y grasas para suministrar la energía necesaria en el periodo postoperatorio. Usualmente el 70% de las calorías no proteicas deben provenir de los carbohidratos durante esta fase, donde es frecuente encontrar hiperglucemia como resultado de la administración de corticoesteroides, el stress físico y la recuperación de la función hepática. En la hiperglucemia es necesario usar grasa (en un 30 a 50%). Largas cantidades de grasa se requieren, pero, estas deben ser utilizadas con precaución y más si son administradas vía venosa para evitar su efecto en la inmunidad y la reducción de toxinas bacterianas en el proceso de aclaramiento del sistema reticuloendotelial. (5)
Después del trasplante las alteraciones de los electrolitos son muy comunes; la gran mayoría de sodio se pierde por la orina, en la sonda nasogástrica y en los drenajes abdominales. Aun cuando el nivel de ascitis es alto y los drenajes abdominales ayudan en la perdida de sodio, este debe restringirse después de la cirugía.
Después de la cirugía se recomienda concentrar los que más se puedan todos los fluidos en muy poco líquido hasta que se decida iniciar un tratamiento diurético agresivo donde se mantendrá un balance de líquidos negativo. El potasio sérico, el fósforo y el magnesio tenderán a estar en niveles muy depletados causados principalmente por la terapia con diuréticos y el síndrome de realimentación. Se puede presentar hiperkalemia por el uso de Cyclosporina y otros diuréticos ahorradores de potasio, además de otras perturbaciones hidroelectrolíticas.
Una dosis de multivitaminicos diaria es de gran recomendación y una dosis semanal de vitamina K.
Los pacientes quienes no se encuentren malnutridos y quienes estén en habilidad de comer después de unos días de la cirugía quizá no sea necesario el soporte nutricional. Una dieta líquida se inicia a los 3 y 4 días después de la cirugía progresando hasta una dieta general sin endulzantes para evitar la hiperglucemia. Se debe observar el patrón alimentario del paciente en búsqueda de inapetencia y anorexia debido a las alteraciones del gusto y a la saciedad temprana; brindar suplementos de ser necesario.
SOPORTE ENTERAL (6)
Este es el método de mayor predilección después de la cirugía de trasplante hepático. Hay mucha evidencia que muestra que hay más beneficios con el soporte enteral que con el soporte parenteral. Muchas comparaciones realizadas sobre esto muestran que el soporte enteral está asociado con menores tasas de infección, disminución del stress metabólico, menores complicaciones técnicas y metabólicas y un mejoramiento y aumento de la síntesis de proteína visceral, además de su menor costo sobre la nutrición parenteral total.
La nutrición enteral se puede instalar en la cirugía con éxito por vía nasoyeyunal o en yeyunostomias. Si se cuenta con fórmulas de moderada o baja osmolaridad, la nutrición enteral se puede iniciar con una baja tasa de infusión unas cuantas horas después del trasplante. Cuando el paciente comienza a comer, el soporte enteral se puede ir transitando solo a tomas nocturnas para estimular el apetito del paciente y permitir un proceso de recuperación más rápido. Una vez se ha confirmado que el conteo de calorías consumidas se adecua a las necesidades del paciente, el soporte enteral se puede descontinuar por completo (5-7 días después del trasplante).
CONCLUSION Y APLICACIÓN PROFESIONAL
En la mayoría de artículos hoy en día consultados y teniendo en cuenta los grados de evidencia de estos, se ha llegado al acuerdo de que son más los beneficios que trae el soporte enteral sobre el parenteral. Sin querer desvirtuar el uso del soporte parenteral total el papel claro del estímulo fundamental del alimento en el tracto gastrointestinal, favorece hasta las condiciones de más alto grado de complejidad como lo es un trasplante hepático.
Tanto en el donante en la condición de un órgano que será sometido a condiciones de hipoxia ex-vivo y a stress metabólico las técnicas de soporte nutricional son fundamentales para el éxito del trasplante. A la vez el paciente quien recibirá el órgano debe estar lo suficientemente bien nutrido y en condiciones metabólicas que le permitan estar lo más protegido posible ante cualquier adversidad, necesitando de esta manera un estado nutricional optimo en términos clínicos que favorezcan al paciente.
La importancia de la preservación de las funciones más fisiológicas en el proceso de alimentario son la mayor ventaja del soporte nutricional enteral. Además teniendo en cuenta que el tracto gastrointestinal es el responsable del mantenimiento de las defensas del organismo como sistema que tiene más del 50% de la función inmunitaria y de mayor contenido en células reticuloendoteliales. (7)
La responsabilidad de un buen grupo de soporte metabólico y nutricional recaba en las condiciones que pueda presentar el paciente después de ser sometido a cualquier procedimiento en donde se requiera de la intervención de este equipo. El estado del paciente, sus futuras instancias nutricionales y metabólicas, la duración en las unidades de cuidados intensivos y hasta en hospitalización, dependen en gran medida de la buena interacción de cada una de las disciplinas del equipo de soporte nutricional en donde la nutrición es la disciplina unificadora.
El profesional Nutricionista Dietista es apto para afrontar cualquier condición que el medio clínico exija en cuestión de opinión profesional sobre la perspectiva clínica de una determinada entidad como lo puede llegar a ser un procedimiento de trasplante de órganos. Cuando, si no lo es en un trasplante hepático en donde se integran todas las áreas del conocimiento de la profesión; es en ese momento donde se exige un nivel de conocimiento integral, fundamentado y actualizado de la actividad como nutricionista clínico.
Los Nutricionistas Dietistas clínicos están llamados a recuperar el área que les corresponde en el equipo de soporte nutricional, a que se reconozca su valor como profesión unificadora y a que se apropien de todas las herramientas necesarias para estar en condiciones de brindar un tratamiento de alta efectividad clínica. Todo dentro de los principios de meritocracia que se haga acreedor el mismo profesional.
NOTAS
- 1. Devlin J et al. Indications for referral and assessment in adult liver transplantation. Gut 1999; 45(suppl 6).
- 2. Kamath PS, et al. A model to predict survival in patients with end stage liver disease. Hepatology 2001; 33: 464-70.
- 3. Lucey MR, Brown KA, et al. Minimal criteria for placement of adults in the liver transplant waiting list. Liver transplant surg 1997; 3: 628-37.
- 4. HARRISON. Principios de medicina interna. 16ª edición. McGraw-hill. Editorial médica. 2005.
- 5. Antonio C.L. Campos, Jorge E.F. Matias and Julio C.U. Coelho. Nutritional aspects of liver trasnplantation. Current Opinions Clinical and Metabolic care. 5:297-307: 2002.
- 6. A, Weimann. M, Braga. L, Harsanyi. Et al. ESPEN guidelines on enteral nutrition: surgery including organ transplantation. Clinical Nutrition. 2006.
- 7. RESTREPO, Patiño J. Metabolismo, nutrición y shock. 4ª edición. Editorial medica Panamericana. 2004.