Hubo dos pacientes quienes no tuvieron diagnóstico FAB específico, uno de ellos presentó leucemia bifenotípica con células T. En total se presentaron 3/40 (7.5%) leucemias bifenotípicas. (Figura 1)
Según la clasificación OMS, el 15% (6/40) de los pacientes pertenecieron al Grupo I; 10% (4/40) al Grupo II, al grupo III 2.5% (1/40) y el resto, 72.5% (29/40) al grupo IV. (Figura 2)
Hemograma
Se encontró anemia en el 100% (40/40) de los pacientes, la mediana de Hemoglobina (Hb) fue de 8.65 g/dL RIQ (7.6-9.7) para hombres de 8.67 g/dL. y para mujeres de 8.68 g/dL. Las anemias normocíticas fueron predominantes con 26/40 casos (65%), seguidas por las macrocíticas con 13/40 casos (32.5%) y solo 1/40 (2.5%) fue microcítica. El Ancho de Distribución Eritrocitaria (ADE) reveló heterogeneidad en 25/40 pacientes (62,5%) con una mediana de 16,35%. RIQ (15,37-18,30). La trombocitopenia estuvo presente en 37/40 pacientes (97,5%) con una mediana de 37000/mL. RIQ (20000-76500). La mediana de glóbulos blancos fue 6400/mL. RIQ (1950-68825), 17/40 pacientes (42,5%) presentaron leucocitosis y 18/40 (45%) leucopenia. El diferencial leucocitario estaba invertido en 28/39 pacientes (71,8%). La mediana de Neutrófilos fue de 10% RIQ (2-16) y la de linfocitos fue de 27% RIQ (8-65). A un paciente no se realizó diferencial ya que su cifra absoluta de Leucocitos era de 600/mL.
Citopatología
La mediana de blastos en la periferia fue de 26.5% RIQ (21-80) mientras que en la médula fue 60% RIQ (21-80). Tan sólo en 13/39 pacientes (33.3%) se hallaron cuerpos de Auer que son característicos de las LMAs. A un paciente no se le hizo aspirado y biopsia de médula ósea debido a su pésimo estado, el diagnóstico fue realizado en sangre periférica.
Inmunofenotipificación
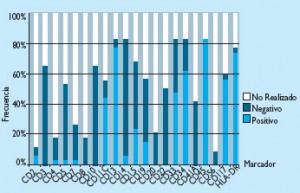
Con respecto a los marcadores inmunofenotípicos, el CD2 fue positivo en 2/4 pacientes uno de ellos con FAB M4 y el otro con leucemia bifenotípica de células T que también tenía CD5 y CD7 positivos. El CD4 fue positivo en un paciente con FAB M5, el CD11c fue positivo en 15/19 pacientes (78,9%) de los cuales 5 tenían leucemia FAB M5 una de ellas bifenotípica con células B y otras 2 con displasia multilinaje.
Los marcadores con mayor positividad en nuestra serie fueron en su orden CD45 en 28/28 casos (100%), CD13 en 26/28 casos (92.9%), HLA-DR en 25/26 casos (96.2%), CD34 en 21/28 (75%) y el CD117 en 19/20 (95%). Los marcadores CD3, CD8, CD10, CD20, CD22, CD41A y CD56 nunca fueron positivos.
A seis de los 40 pacientes (15%) no se les realizó citometria de flujo debido a dificultades administrativas de sus Empresas Administradoras de Planes de Beneficios.
En la figura 3, se muestra la frecuencia relativa de positividad, negatividad y no realización de cada uno de los marcadores analizados en las 34 citometrías de flujo.
Figura 3. Frecuencias relativas de Realización o no de detección de marcadores inmunofenotípicos. Frecuencia relativa de su positividad y negatividad.
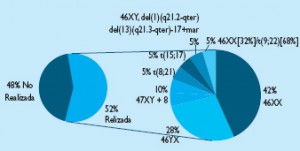
Figura 4. Frecuencia relativa de realización o no de estudio citogenético, Distribución de cariotipos encontrados
El CD117 en 19/20 (95%). Los marcadores CD3, CD8, CD10, CD20, CD22, CD41A y CD56 nunca fueron positivos. A seis de los 40 pacientes (15%) no se les realizó citometria de flujo debido a dificultades administrativas de sus Empresas Administradoras de Planes de Beneficios.
En la figura 3, se muestra la frecuencia relativa de positividad, negatividad y no realización de cada uno de los marcadores analizados en las 34 citometrías de flujo.
Citogenética
El estudio citogenético fue realizado en 21/40 pacientes (52,5%) de los cuales nueve mujeres (42,9%) y seis hombres (28,6%) poseían un cariotipo normal. Dos cariotipos (9,52%) revelaron trisomia del cromosoma 8 uno de ellos con mosaicismo del 20% (MOS 47XY+8 (20%)/46XY (80%)). Otras alteraciones encontradas fueron t(8;21) en un paciente con M2, t(15,17) en un paciente con M3; 46XY,del(1)(q21.2-qter), del(13)(q21.3-qter)-17+ mar en un paciente con M2 y un mosaicismo 46XX(32%)/t(9;22)(68%) en un paciente con Displasia Multilinaje. (Figura 4).
DISCUSIÓN
En el enfoque de la LMA cada día ganan mayor validez ayudas como la clasificación inmunofenotípica y la citogenética, fundamentales para determinar el tratamiento específico ya sea con quimioterapia o transplante.
Llama la atención la inversión de la razón mujer-hombre (1,2:1) observada en nuestra serie respecto a lo reportado en la literatura (1:1,5); sin embargo para Valk y col fue de 1,08:1 coincidiendo con lo reportado por nuestro grupo (8). Respecto a la presentación de LMA en pacientes mayores de 60 años, concordamos con la literatura ya que 17/40 (42,5%) pacientes se encuentran en dicho rango.
Es de resaltar la mayor frecuencia de M5 observada en el Hospital Pablo Tobón Uribe que no coincide con Löwenberg y col para quien la LMA M2 es la más común (9). La importancia de dicho hallazgo radica en el pronóstico ominoso de la LMA monocítica, que llega a un abordaje terapéutico más agresivo y aumenta la necesidad de transplante. Para Valk y col la M5 fue por poco tan común como la M2 (8), lo cual se ajusta a lo reportado por nosotros. La LMA M3, que en éste estudio ocupó el segundo lugar, según la literatura ocupa el cuarto; sin embargo su frecuencia relativa fue similar, 15% para nuestros pacientes y en la literatura de 10%.
De los 40 pacientes estudiados, 34 (85%) accedieron a la citometría de flujo. Respecto a la citogenética, sólo 21 (52,5%) fueron estudiados, resultando esto en un obstáculo para la búsqueda y hallazgo de anormalidades citogenéticas recurrentes.
Los resultados del estudio inmunofenotípico mostraron gran similitud con lo estandarizado para el diagnóstico de LMA a nivel internacional, ya que los marcadores que fueron positivos se ajustan a lo esperado para cada subtipo de LMA según la clasificación FAB. Por otra parte, marcadores como CD3, CD8, CD10, CD20, CD22, CD41A y CD56 nunca fueron positivos por ser propios de células no mielodes. Esto demuestra la correcta aplicación de la citometria de flujo en el área de hematopatología del laboratorio clínico del hospital para el diagnóstico de malignidades hematológicas.
Por último, el análisis citogenético reveló cariotipos normales en 15/21 (71.5%) de los pacientes lo que concuerda con lo reportado por Grimwade y col (13).
Dicho cariotipo representa un riesgo intermedio al igual que la trisomia 8(5) (13), hallada en dos pacientes, ocupando el primer lugar de frecuencia entre las alteraciones cromosómicas observadas en nuestra serie. Este hallazgo se correlaciona con lo descrito por Valk y col, en cuya serie ocupo también el primer puesto (8); mientras que en la de Grimwade y col, el segundo pero con la misma frecuencia relativa (9%) (13).
De los seis pacientes con alteración cromosómicas, casi todos, 5/6 (83.3%) provenían del área urbana, esto sugiere la necesidad de realizar un estudio de carácter epidemiológico en busca de exposición a agentes potencialmente causantes de LMA.
Con este estudio se hace manifiesta la necesidad de realizar una revisión más amplia que involucre un mayor número de pacientes para de esta forma aportar conclusiones con mayor trascendencia para nuestra población y así poder brindar una atención más adecuada y de mejor calidad a nuestros pacientes.
NOTAS
- Wetzler M, Byrd JC, Bromfield CD. Acute and Chronic Myeloid Leukemia. En: Kasper DL. Y cols. Harrison´s Principles of Internal Medicine. Edición 16a. Estados Unidos de América: McGrawHill; 2005. p. 631-641.
- Aster J, Kumar V. White Cells, Lymph Nodes, Spleen and Thymus. En: Cotran RS. Y cols. Robbins-Pathologic Basis of Disease. Edición 6a. Estados Unidos de América: W.B. Saunders Company; 1999. p. 644-695
- Head DR. Proposed changes in the definitions of Acute Myeloid Leukemia and Myelodysplastic syndrome: are they helpful? Curr Opin Oncol 2002, 14:19-23
- Vardiman JW, Harris NL, Brunning RD. The World Health Organization (WHO) Classification of the Myeloid Neoplasms. Blood; 2002-04:1199
- Löwenberg B, Downing JR, Burnett A. Acute Myeloid Leukemia. N Engl J Med 1999; 341:1051-62.
- Bullinger L et al. Use of Gene-Expression Profiling to Identify Prognostic Subclasses in Adult Acute Myeloid Leukemia. N Engl J Med 2004; 350:1605- 16
- Cancer.gov-PDQ (Base de Datos en Línea). Bethesda, MD: National Cancer Institute; Adult Acute Myeloid Leukemia (PDQ®) Treatment Guide for Healthcare Professionals. Última Actualización 2003/10/20. Disponible en: \t «_blank» http://cancer.gov. Con acceso: 05/29/2004
- Valk PJM et al. Prognostically Useful Gene-Expression Profiles in Acute Myeloid Leukemia. N Engl J Med 2004; 350:1617-28
- Loboguerrero J. Leucemia Aguda del Adulto. En: Chalem F. y cols. Medicina Interna Vol. II Edición 3a. Bogotá, Colombia: Fundación Instituto de Reumatología e Inmunología. 1998; p. 2077-2089.
- Bennett JM, Catovsky D, Daniel M-T. Y cols. Proposals for the Classification of the Acute Leukaemias. Br J Haematol 1976,33:451-458
- Mecucci C, Rosati R, La Starza R. Genetic Profile of Acute Myeloid Leukemia. Rev Clin Exp Hematol 2002; 6.1:3-25
- Giles FJ et al. Acute myeloid leukemia. Hematology. 2002; 73-110.
- Grimwade D y cols. The importance of diagnostic cytogenetics on outcome in AML: analysis of 1,612 patients entered into the MRC AML 10 trial. Blood 1998; 92:2322-33
- Díaz R, Aparicio J. Leucemias Agudas y Síndromes Mielodisplásicos Secundarios al Tratamiento Oncológico. An Med Interna 2003; 20:257-268