Resumen
El struma ovarii es una variante monodérmica rara y altamente especializada del teratoma ovárico maduro que contiene > 50% de tejido tiroideo. Representa 5% de los teratomas ováricos. La mayoría de los casos son benignos.
El tejido tiroideo tiene el mismo espectro de características patológicas que la tiroides normal, incluidos cambios benignos y malignos. La transformación maligna es extremadamente infrecuente y consisten en cáncer de tiroides diferenciado (5 – 10% de los casos). La presentación común es dolor abdominal con masa pélvica palpable. Es muy infrecuente que el struma ovarii maligno presente hipertiroidismo, ya que menos del 10% de los casos presenta evidencia clínica-bioquímica de tirotoxicosis por producción ectópica de hormonas tiroideas. Al ser este tumor bastante infrecuente, faltan pautas de diagnóstico y tratamiento. Se presentamos un caso de tirotoxicosis debida a struma ovarii maligno.
Palabras Clave: Tirotoxicosis; Struma ovarii maligno; Hipertiroidismo; Teratoma ovárico.
Abstract
Struma ovarii is a rare and highly specialized monodermic variant of mature ovarian teratoma containing> 50% thyroid tissue. It represents 5% of ovarian teratomas. Most cases are benign. Thyroid tissue has the same spectrum of pathological features as normal thyroid, including benign and malignant changes. Malignant transformation is extremely uncommon and consists of differentiated thyroid cancer (5-10% of cases). The common presentation is abdominal pain with a palpable pelvic mass. It is very rare that malignant struma ovarii presents hyperthyroidism, since less than 10% of cases present clinical-biochemical evidence of thyrotoxicosis due to ectopic production of thyroid hormones. As this tumor is quite infrequent, diagnostic and treatment guidelines are lacking. We present the case of a case of thyrotoxicosis due malignant struma ovarii.
Keywords: Thyrotoxicosis; Malignant struma ovarii; Hyperthyroidism; Ovarian teratoma.
Introducción
Los tumores de células germinales representan 15-20% de todas las neoplasias ováricas y la mayoría de ellos son teratomas quísticos maduros. El struma ovarii es una variante monodérmica del teratoma ovárico que contiene más del 50% del tejido tiroideo, que generalmente ocurre en mujeres en la quinta y sexta décadas de la vida y se presenta en la mayoría de los casos como tumores anexiales unilaterales (1). La mayoría son benignos, pero cerca del 5% de los casos contiene áreas de carcinoma tiroideo bien diferenciado (2). Debido a su rareza, los datos clínicos y de laboratorio son limitados. La tirotoxicosis asociada al struma ovarii maligno se describe en aproximadamente el 8% de los pacientes, pero la mayoría de los casos son asintomáticos desde el punto de vista tiroideo y las pacientes presentan síntomas atribuibles a los efectos del tumor (3). Se presenta un caso de tirotoxicosis debida a struma ovarii maligno.
Presentación de Caso
Se trata de paciente de 49 años, III gestas, III paras, que consulto por presentar dolor abdominal localizado en fosa iliaca derecha, de leve–moderada intensidad que se irradiaba hacia miembro inferior y dolor lumbar ipsilateral acompañado de aproximadamente 3 meses de evolución. Negaba fiebre, escalofríos, síntomas genitourinarios y cambios en el patrón evacuatorios durante ese periodo. La paciente tenía diagnóstico de tirotoxicosis 18 meses antes y estaba eutiroidea posterior a tratamiento anti-tiroideo y refería ciclos menstruales normales. Negaba el uso de cualquier medicamento, métodos anticonceptivos, hábito tabáquico, consumo de alcohol o uso de drogas recreativas. Al igual que antecedentes personales o familiares de enfermedades o neoplasias ginecológicas.
En el examen físico, la evaluación cardiovascular fue normal. La tiroides estaba de tamaño y textura normal, sin presencia de bocio ni exoftalmos. El abdomen estaba blando, depresible y doloroso en fosa iliaca derecha a la palpación profunda sin signos de abdomen agudo. Se palpaba tumoración pélvica móvil que llegaba hasta la cicatriz umbilical de posible origen anexial. Los exámenes de laboratorio demostraron que la hematología básica, química básica, pruebas de funcionalismo hepático y renal, electrolitos séricos y análisis de orina estaban dentro de límites normales. Los resultados de las pruebas tiroideas fueron los siguientes: triiodotiroxina libre (T3) 3,99 pg/mL (valor normal 2,1 – 3,8 pg/mL), tiroxina libre 1,32 ng/mL (valor normal 0,82 – 1,50 ng/mL), tiroglobulina 50 ng/mL (valor normal menor de 30 ng/mL) y hormona tiroestimulante (TSH) 0,8 picoUI/mL (Valor normal de 0,5 – 3,0 picoUI/mL). Además, los valores de los marcadores tumorales estaban dentro de límites normales. La determinación de anticuerpos antitiroglobulina fue negativa.
La ecografía abdominal reveló tumoración pélvica solida acompañada de pequeña cantidad de líquido libre en abdomen. Las imágenes de tomografía computada y resonancia magnética de abdominopelvica confirmaron la presencia de tumoración irregular y compleja que se originaba del ovario derecho que medía 15 centímetros. La evaluación por imágenes del tiroides estaba sin alteraciones. En vista de estos hallazgos se consideró la posibilidad de struma ovarii funcional maligno con producción ectópica de hormonas tiroideas, por lo que la paciente fue programada para cirugía.
Durante la laparotomía ginecológica, se observó tumoración ovárica derecha sólida, de color gris-amarillenta y de superficie lisa de 16 x 14 x 12 centímetros aproximadamente. No se observó ascitis. Se realizó lavado peritoneal, histerectomía abdominal total con salpingectomía bilateral, omentectomía parcial, apendicetomía y linfadenectomía para-aortica y pélvica.
a evaluación microscópica reveló varias secciones del tumor con tejido tiroideo normal y zonas de carcinoma folicular tiroideo que tenían atipias focales marcadas e incremento de la actividad mitótica (figura 1). No se observó invasión capsular invasión neural o perivascular. El análisis de inmunohistoquímica demostró positividad para factor 1 de transcripción tiroidea y tiroglobulina y pancitokeratina, además de coloración negativo para inhibina, sinaptofisina y citokeratina19. Estos hallazgos llevaron al diagnóstico de carcinoma folicular tiroideo originándose de struma ovarii maligno. La citología del líquido de lavado peritoneal evidenció células inflamatorias y mesoteliales activas. El útero, ovario izquierdo, fondo de saco de Douglas, apéndice, epiplón y ganglios linfáticos no mostraron evidencia de lesiones neoplásicas o metastásicas.
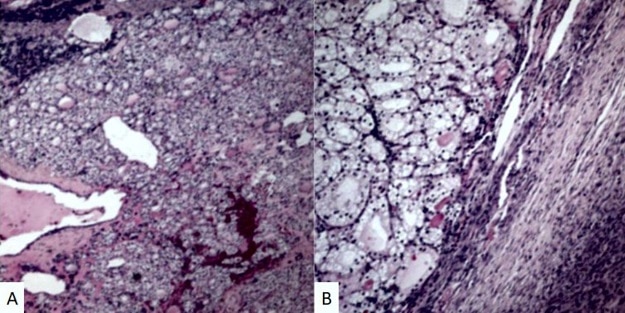
Figura 1. Microfotografía del tejido del ovario derecho que muestra los folículos tiroideos con células atípicas del carcinoma tiroideo apareciendo en el struma ovarii. Se observan atipias nucleares y algunas mitosis. Coloración hematoxilina-eosina A) magnificación 10X. B) Magnificacion 40x.
Durante el postoperatorio la paciente no presentó complicaciones y no se utilizó ningún tipo de quimioterapia adyuvante debido a los hallazgos histopatológicos. En vista del diagnóstico se decidió descontinuar el tratamiento anti-tiroideo. Los síntomas clínicos de tirotoxicosis desaparecieron totalmente a las 3 semanas con valores de tiroglobulina de 25 ng/mL. La glándula tiroides permaneció sin cambios durante el seguimiento y la evaluación pélvica no demostró nuevos hallazgos. La paciente fue monitorizada con controles de tiroglobulina cada 3-6 meses para detección de recurrencia de la enfermedad. Durante el seguimiento postoperatorio en el primer año, la paciente permaneció eutiroidea con valores de tiroglobulina normales.
Discusión
El struma ovarii es un teratoma ovárico raro, maduro y monodérmico, que muestra todas las características histológicas de la glándula tiroides y dependiendo del patrón histológico se clasifica como benigno o maligno (2). La frecuencia de transformación maligna es difícil de establecer, debido a la ausencia de criterios diagnósticos uniformes combinados con la rareza de la condición. La incidencia máxima del struma ovarii maligno se encuentra en la quinta década de la vida (4). Menos del 8% de los pacientes presenta hipertiroidismo, y cuando lo hacen, suele ser leve y subclínico (5,6).
La patogenia de la tirotoxicosis causada por el struma ovarii no se comprende completamente. El perfil hormonal no difiere del hipertiroidismo primario y la tiroides no está aumentada de tamaño. La captación de yodo radiactivo es baja o ausente en la glándula tiroides, pero está presente en la pelvis. Existen informes de pacientes con enfermedad de Graves preexistente o concomitante en los que se ha comprobado que los autoanticuerpos contra el receptor de TSH estimulan la producción de hormona tiroidea en los tejidos tiroideos eutópicos y ectópicos (7). Parece que en la mayoría de los casos hipertiroidismo secundario a struma ovarii la producción autónoma de hormona tiroidea por parte del tejido ectópico no está relacionada con la presencia de anticuerpos del receptor de TSH o con mutaciones de ganancia de función del receptor de TSH, sino con mecanismos más parecidos a los del bocio multinodular tóxico (3).
Las pacientes con struma ovarii maligno generalmente son asintomáticos o refieren de síntomas inespecíficos similares a otras neoplasias ováricas como dolor abdominal, tumoración abdominal palpable y ascitis. La presencia de ascitis (15% – 20% de los casos) no indica malignidad y su origen puede deberse a torsión del pedículo, presión del tumor sobre vasos sanguíneos y linfáticos abdominales o reacción inflamatoria. Se debe descartar la posibilidad de un carcinoma papilar primario de tiroides con metástasis ovárica, demostrando la ausencia de lesiones tiroideas por estudio con imágenes, el tumor puede ser similar a un tumor epitelial o de células germinales del ovario. El CA-125 no es un marcador tumoral específico para el struma ovarii maligno, pero puede serlo para tumores de células germinales del ovario (5,8).
El struma ovarii maligno se debe diagnosticar utilizando las mismas pautas histológicas que para el carcinoma de tiroides, aunque se han propuesto varios criterios diagnósticos diferentes en función de hallazgos anormales que incluyen atipia celular, anormalidad arquitectónica, invasión y / o metástasis (4). La variedad papilar es el subtipo histológico más común (44%), seguido del carcinoma folicular (30%) y la variante folicular del carcinoma papilar (26%) (2,9). Solo se producen metástasis en 5% y se observan en peritoneo, cerebro, pulmones, hígado y ovario contralateral, pero la propagación de los ganglios linfáticos es rara (1). Desde el punto de vista inmunohistoquímico, estos tumores se colorean de forma positiva tanto para tiroglobulina como para factor 1 de transcripción tiroidea (9).
Los diagnósticos diferenciales incluyen adenocarcinoma endometrioide o mucinoso, tumores de las células de Sertoli-Leydig y carcinomas micoacinares metastásicos del tracto gastrointestinal superior (8). El diagnóstico diferencial entre las neoplasias foliculares tiroideas benignas y malignas es desafiante, con patrón de crecimiento folicular y cápsula indefinida. La incidencia de malignidad también es difícil de evaluar debido a la naturaleza rara de este caso y la ausencia de criterios diagnósticos estandarizados (3).
No existe acuerdo sobre el manejo óptimo del struma ovarii maligno. El tratamiento estándar es la cirugía conservadora (histerectomía abdominal total, salpingooforectomía bilateral) y estadificación quirúrgica completa, incluidos lavado peritoneal para citología, omentectomía biopsia de ganglios linfáticos pélvicos y para-aórticos. En las mujeres que desean preservar la fertilidad y el tumor se encuentra clínicamente confinado al ovario se puede considerar ooforectomía unilateral. Estos casos generalmente no requieren tratamiento con yodo radioactivo después de la ooforectomía y se sugiere el uso de levotiroxina para suprimir la TSH (valores en el rango de 0.1 a 0.5 mIU / l durante los primeros 5 años en pacientes sin evidencia de la enfermedad activa) (3-5). La tiroidectomía seguida de ablación con yodo radioactivo se recomienda a pacientes con enfermedad avanzada, metástasis o enfermedad recurrente. La tiroidectomía total no solo permite que el tratamiento con radio-yodo sea efectivo, sino que también facilita el monitoreo de los valores de tiroglobulina durante el seguimiento (9). Esta determinación de tiroglobulina proporciona información útil, ya que sirve como marcador tumoral sensible para monitoreo clínico o la actividad de la enfermedad las concentraciones altas sugieren enfermedad metastásica (2,10). En su estudio, el tiempo promedio para la detección de recurrencia fue de 4 años y sugieren un seguimiento a 10 años de los niveles de tiroglobulina (8).
Conclusión
El struma ovarii maligno es un teratoma de ovario con más del 50% de tejido tiroideo. La tirotoxicosis debida por el tejido tiroideo dentro del tumor es muy rara. Los criterios histológicos para la malignidad son controversiales. El tratamiento convencional es quirúrgico con extirpación de la tumoración. Si existe evidencia de enfermedad extra-ovárica se debe realizar tiroidectomía total más ablación con yodo radioactivo. Se deben tener en cuenta las complicaciones de la tirotoxicosis al evaluar cualquier tumor de ovario.
Referencias
- Lebreton C, Al Ghuzlan A, Floquet A, Kind M, Leboulleux S, Godbert Y. Thyroid carcinoma on struma ovarii: Diagnosis and treatment. Bull Cancer. 2018;105(3):281-289. doi: 10.1016/j.bulcan.2017.11.014.
- Hassan SA, Akhtar A, Falah NU, Sheikh FN. Malignant Thyroid-type Papillary Neoplasm in Struma Ovarii: A Case Report. Cureus. 2019;11(12):e6450. doi: 10.7759/cureus.6450.
- Mimura Y, Kishida M, Masuyama H, Suwaki N, Kodama J, Otsuka F, Kataoka H, Yamauchi T, Ogura T, Kudo T, Makino H. Coexistence of Graves’ disease and struma ovarii: case report and literature review. Endocr J. 2001;48(2):255-60. doi: 10.1507/endocrj.48.255.
- Fukunaga M, Ishibashi T, Koyama T, Onoue K, Kitai S, Tanaka K, Isonishi S. Malignant Struma Ovarii With a Predominant Component of Anaplastic Carcinoma. Int J Gynecol Pathol. 2016;35(4):357-61. doi: 10.1097/PGP.0000000000000265.
- Cui Y, Yao J, Wang S, Zhao J, Dong J, Liao L. The Clinical and Pathological Characteristics of Malignant Struma Ovarii: An Analysis of 144 Published Patients. Front Oncol. 2021;11:645156. doi: 10.3389/fonc.2021.645156.
- Li S, Yang T, Xiang Y, Li X, Zhang L, Deng S. Clinical characteristics and survival outcomes of malignant struma ovarii confined to the ovary. BMC Cancer. 2021;21(1):383. doi: 10.1186/s12885-021-08118-7.
- Nagai K, Yoshida H, Katayama K, Ishidera Y, Oi Y, Ando N, Shigeta H. Hyperthyroidism due to struma ovarii: Diagnostic pitfalls and preventing thyroid storm. Gynecol Minim Invasive Ther. 2017;6(1):28-30. doi: 10.1016/j.gmit.2016.05.002.
- Devi P, Aghighi M, Mikhail N. Papillary Thyroid Carcinoma in Struma Ovarii. Cureus. 2020;12(4):e7582. doi: 10.7759/cureus.7582.
- Gonet A, Ślusarczyk R, Gąsior-Perczak D, Kowalik A, Kopczyński J, Kowalska A. Papillary Thyroid Cancer in a Struma Ovarii in a 17-Year-Old Nulliparous Patient: A case Report. Diagnostics (Basel). 2020;10(1):45. doi: 10.3390/diagnostics10010045.
- Tan A, Stewart CJ, Garrett KL, Rye M, Cohen PA. Novel BRAF and KRAS Mutations in Papillary Thyroid Carcinoma Arising in Struma Ovarii. Endocr Pathol. 2015;26(4):296-301. doi: 10.1007/s12022-015-9394-3.